I 腾盛博药中和抗体递交紧急使用授权申请
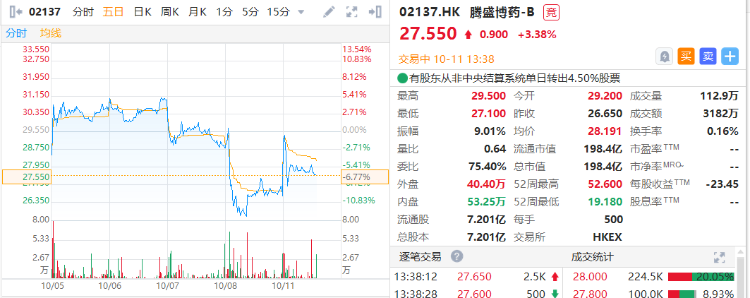
10月10日,腾盛博药公告表示,公司已经向FDA递交新冠中和抗体BRII-196/BRII-198的紧急使用授权(EUA)申请。
该EUA申请是基于NIH支持的ACTIV-23期临床试验积极结果。数据显示,与安慰剂相比,BRII-196/BRII-198联合疗法使临床进展为重度疾病高风险的COVID-19门诊患者,其住院和死亡风险降低78%,具有统计学显著意义,并且其安全性优于安慰剂。
截至发稿,腾盛博药涨3.38%,报27.55港元,市值为198.40亿港元。
来源:华盛通
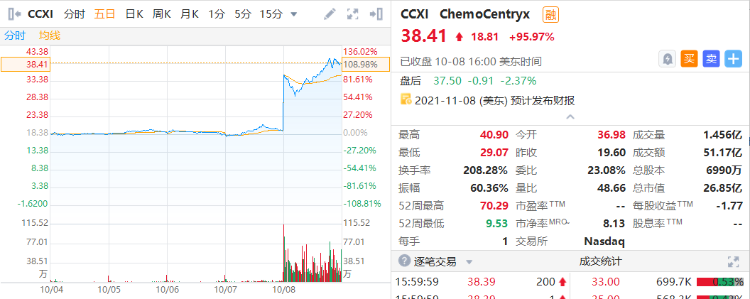
I FDA批准首款口服小分子补体5a受体抑制剂,ChemoCentryx股价大涨96%
10月8日,ChemoCentryx宣布,美国FDA批准该公司first-in-class口服选择性小分子补体5a(C5a)受体抑制剂Tavneos(avacopan)上市。Tavneos是FDA批准的首款口服C5a受体抑制剂,也是近十年来批准的首个治疗ANCA相关血管炎的药物。受此消息影响,截止收盘ChemoCentryx股价大涨95.97%。
来源:华盛通
Tavneos获批的适应症为:与标准疗法联用,辅助治疗严重活动性抗中性粒细胞胞浆自身抗体相关血管炎(也称为ANCA相关血管炎或ANCA血管炎)成人患者。尤其是ANCA血管炎的两种主要形式:肉芽肿性多血管炎(GPA)和显微镜下多血管炎(MPA)。

I 强生重磅CD38单抗皮下注射剂即将在华获批上市
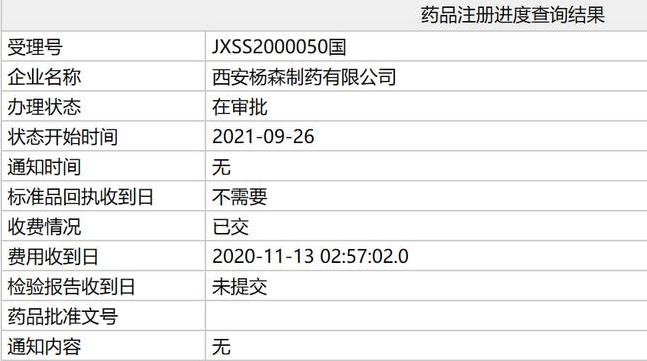
近日,国家药监局官网显示,强生CD38单抗达雷妥尤单抗注射液(皮下注射)上市申请(JXSS2000050)已处于“在审批”阶段,将于近期获批上市,用于治疗原发性轻链型淀粉样变患者。此前该药物上市申请曾获CDE优先审评资格。
达雷妥尤单抗皮下注射剂是达雷妥尤单抗和重组人透明质酸酶PH20(rHuPH20)组成的固定剂量复方,商品名为DARZALEX FASPRO。该产品已在美国获批用于治疗多发性骨髓瘤和轻链淀粉样变性患者。
来源:NMPA官网
I 恢复80%头发生长!礼来公布JAK抑制剂治疗斑秃III期临床结果
近日,礼来和Incyte联合公布了JAK抑制剂Olumiant(巴瑞替尼,baricitinib)治疗斑秃(AA)的两项关键性III期临床研究BRAVE-AA1和BRAVE-AA2的详细结果。
研究结果显示,每日口服1次4mg巴瑞替尼的重度斑秃患者在第24周时就能实现优于安慰剂的显著的头皮毛发再生。该公司计划今年下半年向美国FDA递交监管申请,巴瑞替尼有潜力成为全球数百万斑秃患者的首款疗法。
两项研究中,与安慰剂相比,巴瑞替尼4mg组有近1/3患者在36周时实现眉毛和睫毛的完全再生或再生,而安慰剂这一比例仅在3.1%-5.6%之间,达到研究关键次要终点。

I 切入中国抑酸市场 上海医药6.9亿引进重磅新药
10月8日,上海医药公告表示,以最高不超过6.9亿元的价格,获得贵州生诺新型抑酸剂 X842 原料药及制剂在中国区域的商业化权益。X842能够竞争性地阻断钾离子与质子泵(H+/K+-ATP酶)结合,从而对胃酸分泌产生强大而持久的抑制效果。
已有临床数据显示,X842有可能成为一种用于治疗严重食管炎(C级和D级),以及对PPI治疗响应不佳患者的潜在疗法。目前,X842针对反流性食管炎的临床研究已进展至3期临床阶段。

来源:企业公告
I 开拓药业治疗晚期肝癌ALK-1单抗获批临床
10月8日,据CDE官网,开拓药业GT90001获批临床,适应症为联合纳武利尤单抗用于未经系统性治疗的晚期肝细胞癌治疗。
GT90001为ALK-1(活化素受体样激酶-1)全人源单克隆抗体。ALK-1抗体可通过阻止ALK-1受体通路来抑制肿瘤血管生长、减少血流及血管生成,从而减缓肿瘤生长,亦可改变肿瘤微环境,有望用于多种实体肿瘤的治疗。
开拓药业于2018年自辉瑞获得该药物全球独家开发、生产和商业化的权利。

I 创胜集团PD-L1/TGF-β双抗临床申请获受理
10月9日,CDE官网显示,迈博斯生物的TST005注射液临床试验申请获得药监局受理,适应症是实体瘤。

来源:CDE官网
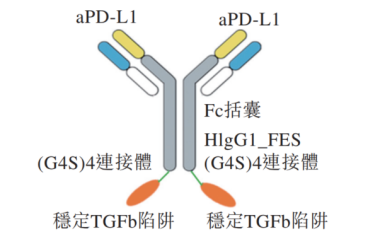
TST005是第二个启动全球临床研究的双功能抗PD-L1和TGF-β trap融合蛋白,同时靶向两个通常被癌细胞用于逃逸免疫抑制的通路。它由高亲和力PD-L1抗体,和融合在其C端的经工程改造的TGF-β受体II型蛋白组成,不结合Fc受体,因此其由Fc受体介导的对表达PD-L1蛋白的效应T细胞的杀伤风险更低。
创胜集团4月21日宣布TST005临床试验申请获得FDA批准,7月15日宣布TST005全球I期临床研究完成首例患者给药。中美同时开发TST005指日可待。
来源:网络
I 治疗阿尔茨海默病,罗氏皮下注射Aβ抗体新药获FDA突破性疗法认定
10月8日,罗氏旗下Genentech(基因泰克)宣布,美国FDA授予该公司皮下注射抗β淀粉样蛋白(Aβ)抗体gantenerumab突破性疗法认定,用于阿尔茨海默病(AD)患者的治疗。Gantenerumab是首款也是唯一一款皮下注射用抗Aβ抗体,目前正在进行一项治疗AD的III期临床研究项目(代号:GRADUATE),预计将于2022年下半年获得完整数据。
自渤健/卫材公司Aβ抗体Aduhelm (aducanumab)获FDA加速获批上市以来,多家企业重新开启Aβ靶向疗法的开发。9月27日,渤健/卫材第2款靶向Aβ的抗体lecanemab申报上市。6月24日,礼来靶向淀粉样蛋白β亚型N3pG的单抗donanemab获得了FDA授予的突破性疗法认定并计划在年内申报上市。
国内企业,恒瑞开发的Aβ单抗SHR-1707已在国内获批临床。

I 三叶草生物通过港交所聆讯:重组蛋白新冠疫苗最早年底上市,已与GAVI签4.14亿剂预购协议
据报道,四川三叶草生物制药有限公司(Clover Biopharmaceuticals,下称“三叶草生物”)已通过港交所聆讯并披露聆讯后材料,高盛、中金公司担任联席保荐人。
三叶草生物是一家临床阶段生物技术公司,致力于开发新型疫苗及生物治疗候选产品,解决全球最危及生命的疾病及公共卫生威胁;凭借其独有的Trimer-Tag平台,有望成为首批在全球范围内商业化COVID-19重组蛋白疫苗的公司之一。
基于Trimer-Tag技术平台,三叶草生物建立了14条管线,包括6种Trimer-Tag亚单位疫苗、两种Trimer-Tag肿瘤候选药物和3种Fc融合候选产品。
IPO前,三叶草生物已获得高瓴、淡马锡、贝达生物医药产业基金、前海母基金等机构的投资。在最后一轮融资完成后,三叶草生物的估值为9.3亿美元。

来源:招股书
风险及免责提示:以上内容仅代表作者的个人立场和观点,不代表华盛的任何立场,华盛亦无法证实上述内容的真实性、准确性和原创性。投资者在做出任何投资决定前,应结合自身情况,考虑投资产品的风险。必要时,请咨询专业投资顾问的意见。华盛不提供任何投资建议,对此亦不做任何承诺和保证。