I 近26亿!云顶新耀引进「mRNA新冠疫苗」
9月13日,云顶新耀宣布,以25.83亿元的总价格引进Providence的mRNA新冠疫苗,后续双方还将合作开发两款mRNA疫苗。

此外,9月13日,根据CDE官网,云顶新耀1类新药「SPR206(EVER206 for injection)」获批临床(受理号:CXHL2101269),用于治疗对本品敏感的革兰阴性菌引起的感染,包括泌尿系统感染、肺部感染、腹腔感染、血流感染等,特别是多重耐药菌引起的感染。
截至发稿,云顶新耀涨超5%,报63.50港元,总市值达189.10亿港元。
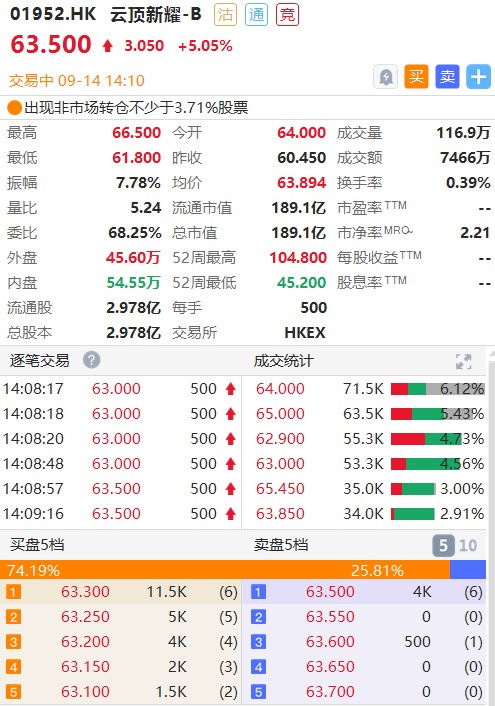
截图来源华盛通桌面PC端,PC端支持多窗口看盘交易,实时把握行情,可在官网下载体验!
I 药明巨诺遭股东折价减持2429.67万股 套现最多5.59亿港元
据报道指,药明巨诺股东TLS Beta Pte Ltd.及Aranda Investments Pte Ltd.,以每股22港元至23港元,配售2429.67万股,套现5.34亿。配股价较昨日收市价折让6.5%至10.57%。
截至发稿,药明巨诺-B跌近12%,报21.65港元,总市值为86.97亿港元。
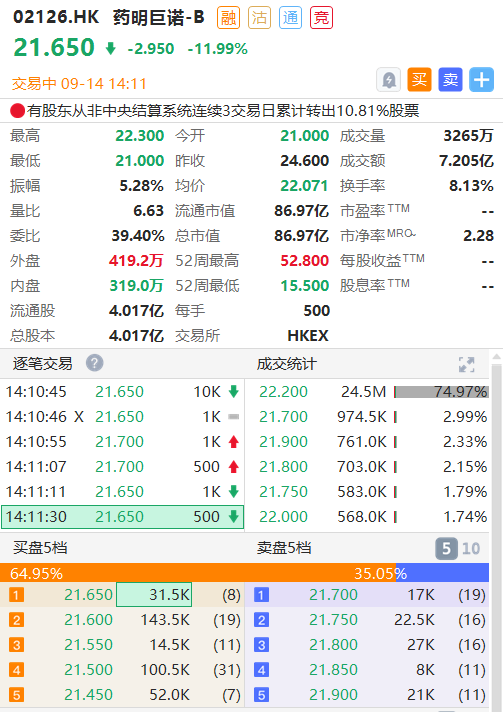
截图来源华盛通桌面PC端,PC端支持多窗口看盘交易,实时把握行情,可在官网下载体验!
I 强生:公司的「埃博拉疫苗方案」在成人和儿童中显示了强劲和持久的免疫反应
《柳叶刀·传染病》杂志数据显示,在第二次注射后21天,几乎所有参与注射的成人和儿童都出现了中和抗体反应。

I 百济神州:FDA已受理「PD-1百泽安」新药上市申请
百济神州于2021年9月13日(美国东部时间)宣布,美国食品药品监督管理局(FDA)已受理其抗PD-1抗体药物百泽安®(替雷利珠单抗注射液)的新药上市申请(BLA),用于治疗既往经系统治疗后不可切除、复发性局部晚期或转移性食管鳞状细胞癌(ESCC)患者。
根据《处方药使用者付费法案》(PDUFA),FDA对百泽安®上市申请做出决议的目标日期为2022年7月12日。
I 《基本医疗保险医用耗材管理办法》拟于年内印发实施
2020年7月,国家医保局印发了《基本医疗保险用药管理暂行办法》,国家医保药品目录将每年动态调整。同时,着手起草了《基本医疗保险医用耗材管理办法》,并公开向社会征求意见,拟于年内印发实施。
下一步,将:
- 按照要求,动态调整医保药品目录,完善谈判准入机制,建立评价规则和指标体系,将符合条件的药品纳入医保支付范围。
- 推进医保医用耗材和诊疗项目管理。
I 诺诚健华科创板IPO获受理:拟募集资金40亿元
据上交所科创板9月13日发行上市动态更新,中国新药创制公司诺诚健华医药有限公司(InnoCare Pharma Limited,下称“诺诚健华”)申请科创板上市已获受理。中金公司为其保荐机构,拟募集资金40亿元,其中21.51亿元拟用于新药研发项目。
今年2月,高瓴资本连同维梧资本增持诺诚健华,注资3.93亿美元。今年上半年该公司亏损同比下降37%,由2020年上半年的3.37亿元降至2021年上半年的2.13亿元。
I 日本最早将于月内批准「葛兰素史克」新冠新药「Sotrovimab」
9月13日消息,日本厚生劳动省计划最早于9月内批准用于治疗轻度和中度新冠患者的点滴注射药“Sotrovimab”。Sotrovimab由英国葛兰素史克(GSK)与美国Vir Biotechnology(VIR)共同开发。拟对不需要采用氧气疗法的轻中度患者在高龄及肥胖等重症化风险较高的情况下使用。
葛兰素史克9月6日在日本申请了简化审批流程的特例批准。如果基于日本《医药品医疗器械法》(原药事法)批准进行生产和销售,该药将成为继日本中外制药的抗体鸡尾酒疗法“Ronapreve”之后用于轻中度新冠的第2种点滴注射药。

I 康宁杰瑞制药-B:「PD-L1/CTLA-4双抗、HER2双抗」相关临床数据积极
9月13日消息,日本厚生劳动省计划最早于9月内批准用于治疗轻度和中度新冠患者的点滴注射药“Sotrovimab”。Sotrovimab由英国葛兰素史克(GSK)与美国Vir Biotechnology(VIR)共同开发。拟对不需要采用氧气疗法的轻中度患者在高龄及肥胖等重症化风险较高的情况下使用。
葛兰素史克9月6日在日本申请了简化审批流程的特例批准。如果基于日本《医药品医疗器械法》(原药事法)批准进行生产和销售,该药将成为继日本中外制药的抗体鸡尾酒疗法“Ronapreve”之后用于轻中度新冠的第2种点滴注射药。
I 和铂医药-B:「CTLA-4单抗」Ⅰ期临床数据积极
9月13日消息,日本厚生劳动省计划最早于9月内批准用于治疗轻度和中度新冠患者的点滴注射药“Sotrovimab”。Sotrovimab由英国葛兰素史克(GSK)与美国Vir Biotechnology(VIR)共同开发。拟对不需要采用氧气疗法的轻中度患者在高龄及肥胖等重症化风险较高的情况下使用。
葛兰素史克9月6日在日本申请了简化审批流程的特例批准。如果基于日本《医药品医疗器械法》(原药事法)批准进行生产和销售,该药将成为继日本中外制药的抗体鸡尾酒疗法“Ronapreve”之后用于轻中度新冠的第2种点滴注射药。
I 基石药业-B:「PD-L1/4-1BB/HSA三抗」治疗「晚期实体瘤」获临床试验批准
9月13日,据CDE官网,由基石药业和Numab Therapeutics AG公司共同开发的NM21-1480注射液获得临床试验批准,用于治疗晚期实体瘤。
根据设计,NM21-1480仅在与肿瘤细胞表面上的PD-L1结合的情况下才会与4-1BB的独特抗原表位相结合,激活抗癌T细胞,从而可能避免出现传统4-1BB激动剂单抗和双抗在临床试验中观察到的肝毒性。此外,通过结合HSA 可延长ND021的半衰期,从而降低患者的给药频率。
风险及免责提示:以上内容仅代表作者的个人立场和观点,不代表华盛的任何立场,华盛亦无法证实上述内容的真实性、准确性和原创性。投资者在做出任何投资决定前,应结合自身情况,考虑投资产品的风险。必要时,请咨询专业投资顾问的意见。华盛不提供任何投资建议,对此亦不做任何承诺和保证。