6月7日晚间,美国食药监局(FDA)批准百健(生化基因/Biogen,BIIB)治疗阿兹海默症(AD)的药物Aduhelm (aducanumab),为该机构2003年以来首次批准治疗阿兹海默症的药物。该药物这有助于延缓患者疾病的肆虐,包括记忆力丧失和照顾自己的能力。
消息传出后,百健一度暴涨近60%,触发两次熔断,最终收涨38.34%,报395.85美元。
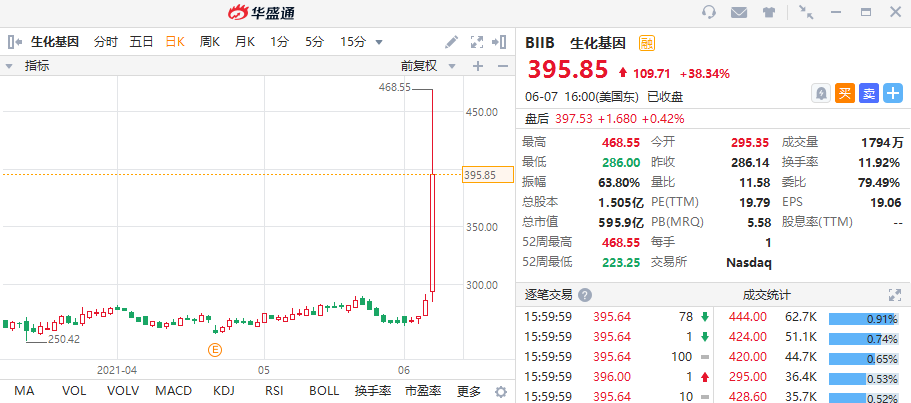
(行情来源:华盛证券)
其他从事阿尔茨海默病疗法研究的公司也闻声上涨:
Cassava Sciences(SAVA)一度大涨17%,该公司此前曾宣布老年痴呆症疗法研究取得积极进展,研究结果支持对药品Simufilam进行第三阶段临床试验。
礼来(LLY)同样在开发相同赛道药物多纳单抗(Donanemab),昨日一度上涨15.6%,创历史新高。
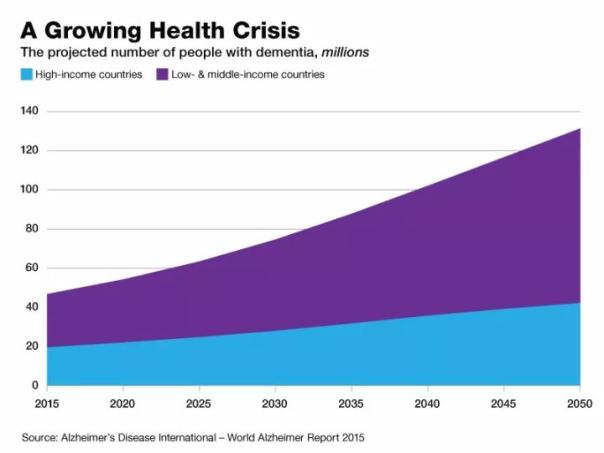
据阿尔茨海默氏症协会估计,超过600万美国人患有此病。据该组织称,到2050年,这一数字预计将上升到近1300万。这种破坏记忆的疾病是美国第六大死亡原因,治疗选择非常有限。
早前,微软创始人比尔·盖茨宣布将个人捐赠1亿美元,向20年来没有新药问世的阿兹海默病发起挑战。
“如果你能活到80多岁,患上阿兹海默病的机会要接近50%,”盖茨在博文中说到:“在美国前十大致死原因里,这是唯一缺乏有效治疗方式的疾病。而且,它正变得越来越流行。”
一、制药巨头纷纷“折戟”
阿尔茨海默症新药研发失败率高达99.6%,进入21世纪以来,已有超过320项临床试验宣告失败,成为最出名且让最多药企折戟的“大坑”。
- 2016年,礼来研发的治疗AD的solanezumab三期临床没有达到主要临床终点,尽管这种药曾经被华尔街分析师寄予厚望,预测一年至少数十亿甚至上百亿美元的销售额。
- 2018年,礼来和阿斯利康宣布终止治疗AD的全球三期临床试验项目lanabecestat(BACE抑制剂)。
- 2020年11月,在FDA针对 aducanumab召开的外部专家咨询委员会上, 几乎所有外部专家都给出了负面评价。此外,外部专家还直言FDA欠缺专业性,认为之前内部给出的积极内部审查意见令他们感到费解。
- 2021年1月,FDA将aducanumab的审评期延长了3个月,以提供额外的审查。
尽管目前FDA批准了其药物,但百健在药物获批后需再进行一次临床试验。FDA表示,百健的试验数据高度复杂,存在不确定性。
对于最关心的定价问题,百健表示,aducanumab的标价为每年5.6万美元,高于一些分析师此前预计的1万至2.5万美元。病人的自付费用将取决于他们的健康保险。

百健首席执行官Michel Vounatsos表示,定价5.6万美元/年的阿尔茨海默病药物是“合理的”,并保证至少在4年内不会涨价。目前推测价格是否会下降还为时尚早。该药物的价格反映了“20年来的无创新”,也将使百健进一步投资于其他疾病药物的研发。
公司估计,大约150万美国人将有资格获得aducanumab,该药物每月需要服用一次。根据数据机构Refinitiv的预测,到2023年aducanumab的年销售额将达到12.6亿美元。
二、最新机构评级
Stifel分析师Paul Matteis重申“买入”评级,并指出获得加速批准的药物很少会在之后被撤回。他补充说,虽然他之前认为,如果获得完全批准,股价将上涨40%-50%,但他认为股价将“基本达到预期水平”。
花旗分析师Mohit Bansal预计,百健股价有望达到每股410美元左右,并为公司提供一个超过120亿美元的全球市场机会,帮助其走上增长之路。
摩根士丹利予“增持”评级,目标价为343美元。然而,随着药物商品化进一步发展,他预计股价将升至375美元以上。该行预计,投资者接下来会把关注重点转向药物配送问题、潜在的治疗速度以及管理层在加快药物处方方面可能面临的任何阻力。
Raymond James将百健从“跑输大盘”上调至“与大市持平”,并承认该行过去18个月对aducanumab审批被拒的预测是“大错特错”。
考虑到该疗法的价格为5.6万美元/年,Truist预计百健的股价将达到846美元/股,这意味着较最新收盘价存在195.7%的上升空间。
在不涨价和80%的患者符合要求的情况下,Truist假设销售成本和毛利润占净收入的比例分别为14%和15%。在治疗成本为2.1万美元/年,价格上涨3%的情况下,该公司在其目前的模型中估计该股的目标价为458美元,意味着比当前水平存在60.1%的上升空间。
美国银行分析师Geoff Meacham对FDA的决定感到惊讶,尤其是该监管机构的审批是基于一项开放标签试验,而没有限制其用于特定患者群体。Meacham预计,这种疗法在商业上可能会令人失望,并低于对治疗患者数量的一致预期。此前,该分析师认为aducanumab获得FDA批准的机率只有25%。
风险及免责提示:以上内容仅代表作者的个人立场和观点,不代表华盛的任何立场,华盛亦无法证实上述内容的真实性、准确性和原创性。投资者在做出任何投资决定前,应结合自身情况,考虑投资产品的风险。必要时,请咨询专业投资顾问的意见。华盛不提供任何投资建议,对此亦不做任何承诺和保证。